
2025年2月16日,由我校葛肖飛老師擔任共同通訊作者之一的研究論文——“一種單核細胞增生李斯特菌來源的F型噬菌體尾樣細菌素的結構”(Structure of an F-type Phage Tail-Like Bacteriocin from Listeria monocytogenes)在頂刊《自然·通訊》(Nature Communications)上成功發表。該研究論文解析了單核細胞增生李斯特菌產生的F型噬菌體尾部樣細菌素monocin的高解析度冷凍電鏡結構,並首次揭示了這一類抗菌蛋白複合物的結構組裝細節,為理解其殺菌機制及開發新型抗菌療法提供了關鍵科學依據。
具體而言,研究團隊透過基因工程技術,於乳酸乳球菌(Lactococcus lactis)中成功表現了monocin的11個結構基因及2個調控基因,並運用冷凍電子顯微鏡技術(cryo-EM)解析其原子級解析度結構。儘管monocin整體結構呈現較高之構象柔性(conformational flexibility),團隊採用分段解析策略,分別獲得了近側「帽區」(Cap domain)、遠側「尖端結構域」(Tip domain)及「側纖維」(Side Fiber)之高解析度三維重構結果。基於多重局部結構之剛性對接(rigid-body docking)及分子動力學優化,最終成功構建完整之分子模型,其結構特徵顯示monocin可能透過模組化結構域協同作用實現其生物學功能。
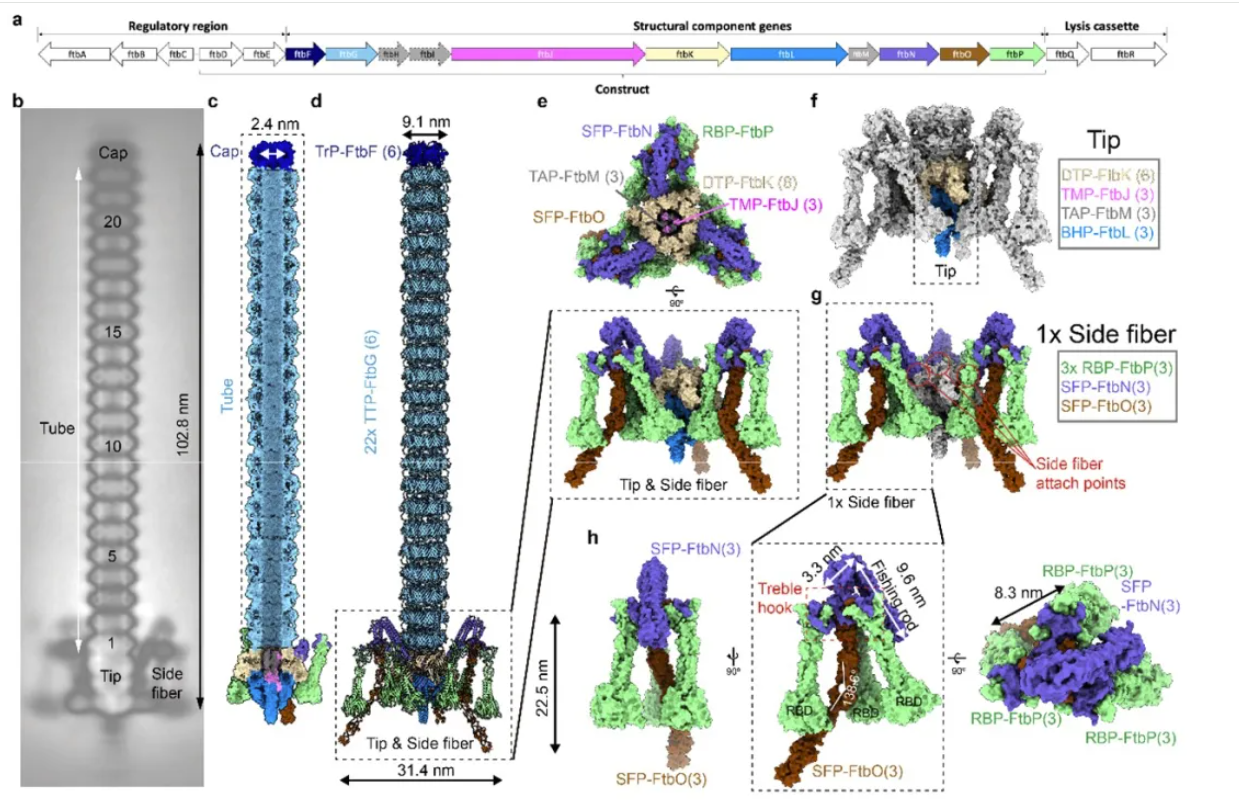
Monocin全長約103納米,由22個六聚體環狀主要尾部蛋白(TTP-FtbG)螺旋狀堆疊形成柔性管狀核心,相鄰環的FtbG由二硫鍵連接。尾管近側由終止蛋白(TrP-FtbF)六聚體封閉形成帽區,遠側則由基板樞紐蛋白(BHP-FtbL)三聚體封閉並形成尾刺,並通過遠側尖端蛋白(DTP-FtbK)三聚體連接的“釣竿-三鉤”複合體(FtbN三聚體)與側纖維結合。
側纖維中,FtbP蛋白三聚體末端的受體結合域(RBD)可精准錨定宿主細胞。側纖維的另一組分FtbO蛋白三聚體通過鐵離子配位元穩定結構。實驗表明,截短或刪除FtbO不影響monocin整體的結構組裝,但會破壞其殺菌活性,表明FtbO可能在殺菌過程中發揮重要功能。
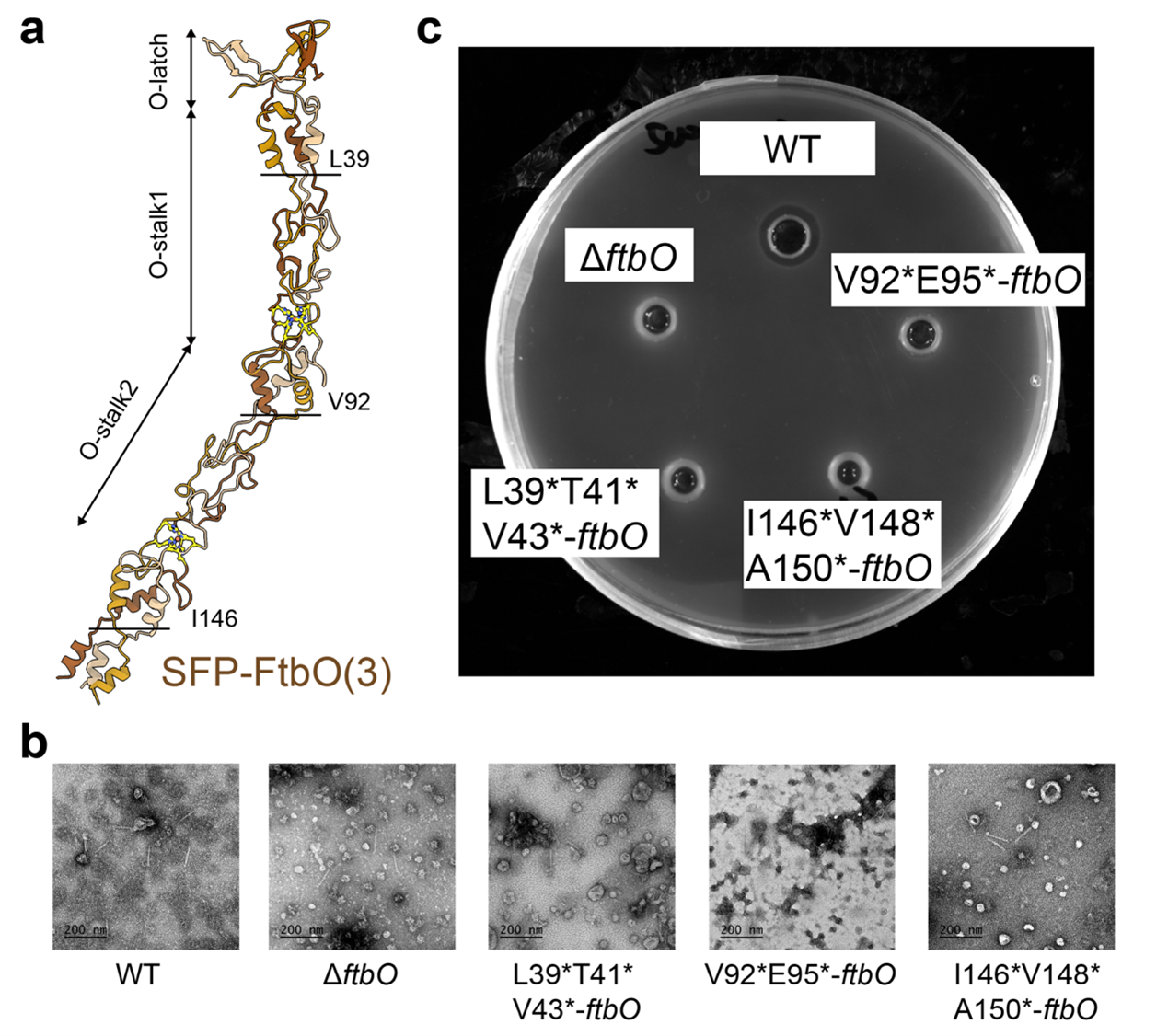
該項研究通過冷凍電鏡分段重構策略,克服了高柔性結構域的技術挑戰,不僅為理解其殺菌機制及開發新型抗菌療法提供了關鍵科學依據,也填補了噬菌體尾樣細菌素在結構生物學領域的空白,意義非凡。
《自然·通訊》(Nature Communications)是多學科類開放獲取期刊中的翹楚,致力於生物、物理、化學和地球科學等各領域的高品質研究,主要發表相關領域具有重大突破的研究成果。
論文鏈接:https://www.nature.com/articles/s41467-025-57075-3

 城大首頁
城大首頁
